病毒感染免疫与抗病毒药物研发团队
一、研究方向
病毒感染引起的新发突发传染病日益频发,严重威胁着人类健康,给公共卫生安全造成了巨大的威胁。然而,针对病毒广谱而高效的抗病毒药物极其缺乏;同时,病毒耐药株的快速出现也给现有抗病毒药物带来了极大挑战。因此,迫切需要解析和澄清病毒的感染分子机制,并研发新型广谱抗病毒药物来有效应对病毒传染病的发生。
本团队聚焦于重要的人类和动物病毒(包括人副流感病毒、呼吸道合胞病毒、寨卡病毒、肠道病毒71型、新冠病毒、埃博拉病毒、尼帕病毒、乙型肝炎病毒等)的感染、复制与致病机制的研究,解析病毒在宿主细胞内的复制、组装、释放及病毒与宿主细胞的相互作用机制;结合结构生物学、生物信息学发现和鉴定新的抗病毒治疗靶点,在筛选传统抗病毒小分子药物的同时还开展包括纳米颗粒疫苗和RNA疫苗在内的多种新型预防和治疗性抗病毒药物的研发。

二、团队成员

|
陈明周,二级教授,博士生导师。国家杰出青年科学基金项目获得者、教育部“新世纪优秀人才”、湖北省省级高层次人才、湖北大学生物学首席科学家;现任湖北大学生命科学学院院长;曾任武汉大学生命科学学院副院长、病毒学国家重点实验室副主任;现担任国际期刊 Journal of Virology 和 Virologica Sinica 编委、Frontiers in Cellular and Infection Microbiology 副主编。长期从事病毒感染和致病的分子机制研究:解析了病毒“复制细胞器”生物发生与稳态调控的分子机制;筛选并发现了多个广谱的抗呼吸道病毒抑制剂和多肽。以通讯作者在Cell Host & Microbe、Cell Discovery、Autophagy、Cell Reports、Protein & Cell、PLoS Pathogens、Journal of Virology等国际权威期刊发表论文30多篇。先后主持国家杰出青年科学基金项目、国家自然科学基金重点项目、科技部国家重点研发计划项目课题、教育部新世纪优秀人才支持计划、湖北省自然科学基金创新群体、湖北省自然科学杰出青年基金等多项国家级和省部级科研项目。 Email:chenmz@hubu.edu.cn |

|
覃雅丽,教授,博士生导师。先后在在法国国家健康和医学研究所和里昂第一大学从事博士后工作,并继续在美国凯斯西储大学、爱荷华州立大学进行病毒学研究,主要从事病毒感染与宿主互作,病毒调节宿主脂质代谢的分子机制研究与抗病毒药物及新型疫苗研发。主持国家基金委面上项目 1 项(2019 年), 区域联合基金项目 1 项(2022 年),湖北省自然基金面上项目 1 项(2019 年),参与科技部重点研发计划 1 项(2021 年);以通讯作者在 Cell Reports(2 篇)、PLoS Pathogens(2 篇)、Journal of Virology(2 篇)、 Cell Insight(1 篇)和 Viruses(2 篇)等国际权威期刊上发表论文多篇。 Email:yqin@hubu.edu.cn |

|
张胜威,特任研究员,硕士生导师。湖北省生物工程学会会员,中国生物化学与分子生物学学会会员。2017年10月-2019年2月在宾夕法尼亚大学Perelman医学院从事博士后研究。2023年11月进入湖北大学生命科学学院任教。主要从病毒与宿主互作的角度解析负链RNA病毒RNA合成与病毒粒子组装/出芽的切换机制及RNA甲基化修饰调控负链RNA病毒复制的机制等。在国际著名期刊如 PLoS Pathogens、Journal of Virology、Viruses、Virology 上以第一作者或共同第一作者身份发表SCI论文6篇,同时主持2项省部级科学基金项目,参与国家自然科学基金项目3项;参编了第四版《分子诊断学》数字化教材、《现场医护POC现状和进展》等多部专业教材和著作。 Email:zsw189@163.com |

|
胡柱龙,副教授。2012-2018年于武汉大学获得博士学位,2018-2022年在中山大学肿瘤防治中心从事博士后研究,主要从事病毒与宿主相互作用机制探究和新型疫苗研发工作。曾以呼吸道合胞病毒PreF蛋白为靶点,基于mi3、I53-50等多种自组装纳米颗粒平台开发出新型疫苗;基于VSV病毒载体平台开发出针对鼻咽癌病毒(EBV)的新型疫苗;阐明了人副流感病毒(HPIV3)通过调控应激颗粒的形成逃逸宿主抗病毒免疫反应的分子机制。为预防呼吸道病毒感染以及鼻咽癌的防治提供了新的研究策略和理论基础。近5年来,主持国家自然科学基金青年项目1项(2022年),中国博士后科学基金面上项目1项(2018年),广东省自然科学基金青年项目1项(2021年)。以第一或通讯作者在病毒学权威期刊PLoS Pathogens和Journal of Virology发表SCI论文2篇。 Email:huzl@hubu.edu.cn |

|
李智菲,副教授。2019年12月毕业于武汉大学微生物学专业,获理学博士。2020年1月-2023年7月在武汉大学生命科学学院从事博士后研究。2023年8月进入湖北大学生命科学学院任教。主要聚集重要人类及动物病毒的复制机制,解析病毒复制细胞器的生物合成及功能发挥的机制,挖掘病毒复制过程中的抗病毒新靶标,筛选与设计新型抗病毒药物等。在主流学术期刊Cell Host & Microbe、Cell Reports、Cell Insight、Journal of Virology、Virologica Sinca发表SCI论文5篇。主持国家自然科学基金原创探索项目1项,国家自然科学基金青年基金项目1项、中国博士后面上项目1项,湖北省创新博士后资助项目1项。 Email:zhifeili@hubu.edu.cn |

|
张林亮,副教授。省级人才项目入选者,湖北省生物工程学会会员。长期从事RNA病毒(包括高致病性以及新发突发病毒)感染和致病机理的研究以及抗病毒小分子药物的筛选,系统解析了蛋白质翻译后修饰(乙酰化、泛素化等)调节病毒复制的分子机制:1、提出泛素化调节人副流感病毒基质蛋白作为自噬受体,诱导线粒体自噬的新理论;2、发现乙酰化是埃博拉病毒基质蛋白出芽的直接驱动力,挖掘出表观药物姜黄素治疗埃博拉病毒病的潜在价值。相关研究成果发表在Cell Host & Microbe、Autophagy、Signal Transduction and Targeted Therapy、PLoS Pathogens等病毒学领域权威期刊上。主持纵向科研项目4项,包括国家自然科学基金青年项目(32200127)等。 Email: zlinliang@hubu.edu.cn |

|
郑颖城,特任副研究员。2020年6月毕业于武汉大学免疫学专业,获得医学博士学位。2020年7月-2023年8月在武汉大学医学病毒研究所从事博士后研究。2023年10月进入湖北大学生命科学学院任教。目前的研究领域为乙肝病毒的致病机制及治疗策略。以第一作者身份在PLoS Pathogens、Journal of Virology等国际知名学术期刊发表SCI论文多篇。 Email:zhengyingcheng@hubu.edu.cn |

|
乔嘉璐,副教授,硕士生导师。湖北省免疫学学会会员,Frontiers in Immunology客座编辑。主要从事病毒与神经系统相互作用机制研究,抗病毒治疗新策略开发和抗病毒药物的前期筛选。在Journal of Agricultural and Food Chemistry、Virologica Sinica、Cellular Signalling, Frontiers in Immunology、AIDS research and human retroviruses 等国际权威杂志上发表高水平学术论文10余篇,申请发明专利2项。主持国家自然科学基金青年项目1项、省市级课题3项。 Email: qiaojl@163.com |

|
胡云虹,副教授,硕士生导师。2016年6月于武汉大学生命科学学院获得博士学位。主要从事细胞抗病毒天然免疫应答及细胞炎症反应的相关研究,鉴定参与这些反应的蛋白质并解析其发挥作用的分子机制。以第一作者或通讯作者身份在EMBO Reports、Cellular & Molecular Immunology、Biotechnology Letter等国际权威杂志上发表高水平学术论文3篇。主持国家自然科学基金青年项目1项。 Email: huyunhong@hubu.edu.cn |
三、代表性研究成果
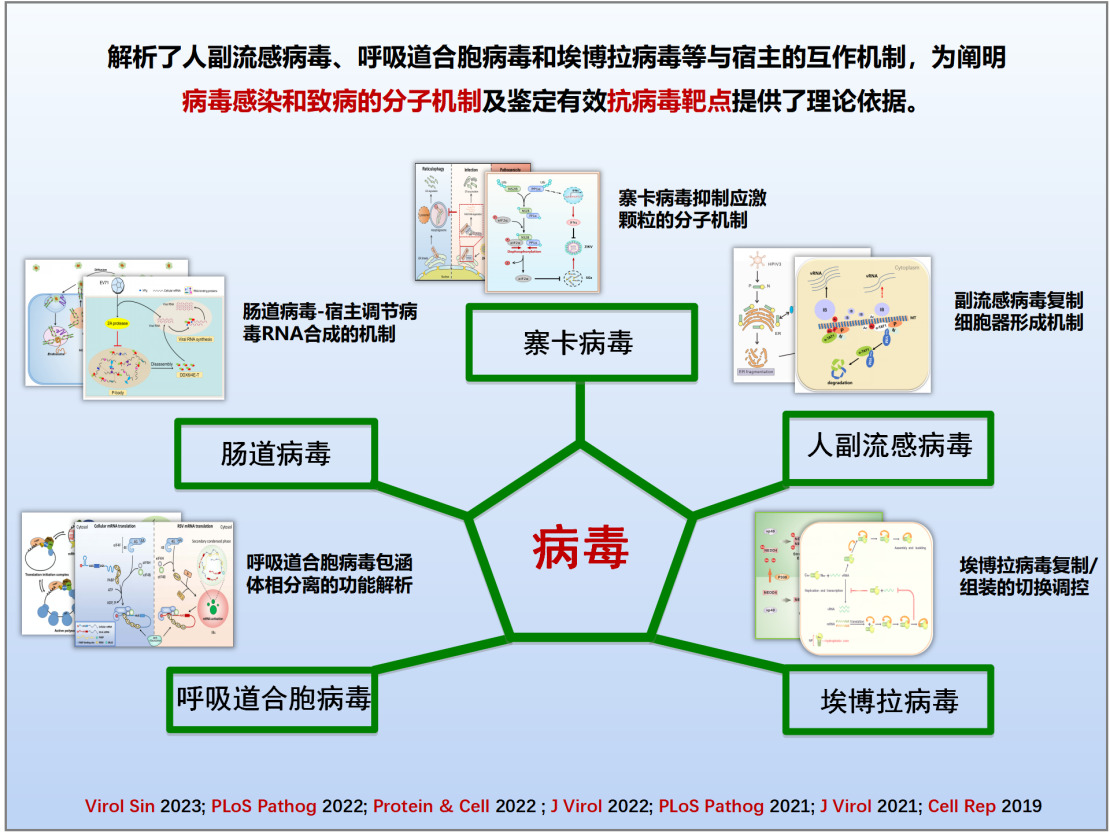
(一)阐明病毒-宿主相互作用的分子机制
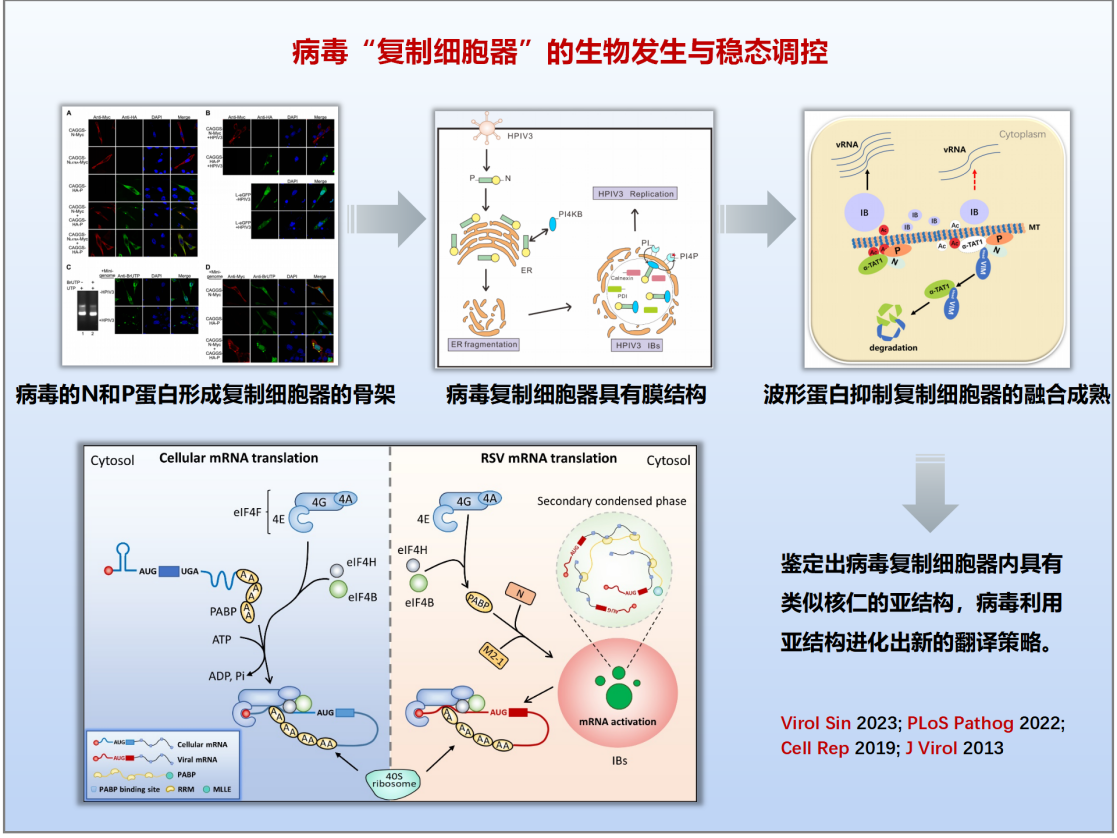
(二)揭示病毒“复制细胞器”生物发生与稳态调控
(三)发现病毒粒子组装和释放的新机制
(四)提出RNA病毒抑制干扰素产生新理论
(五)新型疫苗和抗病毒药物研发

四、科研项目(部分)
1. 国家自然科学基金原创探索类项目(32350014):负链RNA病毒诱导“病毒巢”重塑的分子机制研究,2024.01-2025.12,160万
2. 国家自然科学基金联合基金项目(U22A20337):新冠病毒诱导脂噬重排脂质流向以调控复制细胞器生物发生及膜特性的机制研究,2023.01-2026.12,255万
3. 湖北省重点研发计划(2023BCB087):靶向宿主囊泡运输途径关键调节因子RAB11的广谱型抗呼吸道病毒多肽研发,2023.01-2025.12,100万
4. 国家自然科学基金重点项目(82130064):人副流感病毒3型复制细胞器生物合成及功能发挥的分子机制,2022.01-2026.12,290万
5. 国家重点研发计划 “病原学与防疫技术体系研究” 专项(2021YFC2300702):病毒复制与宿主相互作用研究及药物靶点发现, 2021.12-2024.11,687万
6. 国家杰出青年科学基金项目(81825015):RNA病毒感染和致病的分子机制,2019.01-2023.12,400万
7. 国家科技重大专项(2018ZX10101004):艾滋病和病毒性肝炎等重大传染病防治,2018.01-2020.12,114万
8. 国家自然科学基金重点项目(31630086):人副流感病毒诱导的线粒体自噬及其调控先天免疫和病毒复制的机制,2017.01-2021.12,287万
9. 国家自然科学基金青年项目(82203230):EB 病毒蛋白BRRF2 通过外泌体抑制天然免疫的作用及机制,2023.01-2025.12,30 万
10. 国家自然科学基金青年项目(32200127):去乙酰化酶HDAC10抑制埃博拉病毒基质蛋白出芽的机制研究,2023.01-2025.12,30万
11. 国家自然科学基金青年项目(32100131):SARS-CoV-2非结构蛋白Nsp5与Bcl2相互作用诱导线粒体损伤激活NLRP3炎症小体的分子机制研究,2022.01-2024.12,30万
12. 国家自然科学基金青年项目(32000119):人副流感病毒3型诱导未折叠蛋白反应的机制研究,2021.01-2023.12, 30万
13. 国家重点研发计划子课题:虫媒病毒感染和传播机制及防治干预靶点的发现,2021.12-2025.11,64万
14. 国家自然科学基金面上项目:人副流感病毒3型包涵体调节病毒RNA合成的分子机制,2019.01-2022.12,57万
15. 湖北省自然科学基金创新群体(2017CFA022),2017-2019,50万
16. 国家自然科学基金青年项目(31500135):人副流感病毒3型磷酸蛋白氨基端功能区域的研究,2016.01-2018.12,30万
17. 国家自然科学基金面上项目(81471939):人副流感病毒3型核衣壳蛋白的功能研究,2015.01-2018.12,100万
18. 国家自然科学基金面上项目(81271816):水泡性口炎病毒磷酸蛋白氨基端磷酸化的功能研究,2013-2016,70万
五、研究论文(部分)
1. Yingcheng Zheng, Mengfei Wang, Jiatong Yin, Yurong Duan, Chuanjian Wu, Zaichao Xu, Yanan Bu, Jingjing Wang, Quan Chen, Guoguo Zhu, Kaitao Zhao, Lu Zhang, Rong Hua, Yanping Xu, Xiyu Hu, Xiaoming Cheng, Yuchen Xia, Hepatitis B virus RNAs co-opt ELAVL1 for stabilization and CRM1-dependent nuclear export. PLoS Pathogens. 2024
2. Yingcheng Zheng, Mengfei Wang, Sitong Li, Yanan Bu, Zaichao Xu, Guoguo Zhu, Chuanjian Wu, Kaitao Zhao, Aixin Li, Quan Chen, Jingjing Wang, Rong Hua, Yan Teng, Li Zhao, Xiaoming Cheng, Yuchen Xia, Hepatitis B virus hijacks TSG101 to facilitate egress via multiple vesicle bodies. PLoS Pathogens. 2023
3. Qiang Zhang, Hanzhe Ye, Cong Liu, Haiwu Zhou, Mingbin He, Xiaodong Liang, Yu Zhou, Kun Wang, Yali Qin, Zhifei Li, Mingzhou Chen. PABP-driven secondary condensed phase within RSV inclusion bodies activates viral mRNAs for ribosomal recruitment. Virologica Sinica. 2023
4. Zhifei Li, Miaomiao Zheng, Zhicheng He, Yali Qin, Mingzhou Chen. Morphogenesis and functional organization of viral inclusion bodies. Cell Insight. 2023
5. Shan Zong#, Yan Wu#, Weiling Li, Qiang You, Qian Peng, Chenghai Wang, Pin Wan, Tao Bai, Yanling Ma, Binlian Sun*, Jialu Qiao*, SARS-CoV-2 Nsp8 induces mitophagy by damaging mitochondria. Virologica Sinica. 2023
6. Pengfei Liu, Shengwei Zhang, Jingyi Ma, Dongning Jin, Yali Qin, Mingzhou Chen. Vimentin inhibits α-tubulin acetylation via enhancing α-TAT1 degradation to suppress the replication of human parainfluenza virus type 3. PLoS Pathogens. 2022
7. Xiang-Wei Kong#, Xiao Zhang#, Guo-Long Bu#, Hui-Qin Xu, Yinfeng Kang, Cong Sun, Qian-Ying Zhu, Run-Bo Ma, Zheng Liu, Yi-Xin Zeng, Mu-Sheng Zeng*, Zhu-Long Hu*. Vesicular Stomatitis Virus-Based Epstein-Barr Virus Vaccines Elicit Strong Protective Immune Responses. Journal of Virology. 2022
8. Dong Guo, Xinghai Yu, Dan Wang, Zhifei Li, Yu Zhou, Guodong Xu, Bing Yuan, Yali Qin, Mingzhou Chen. SLC35B2 Acts in a Dual Role in the Host Sulfation Required for EV71 Infection. Journal of Virology. 2022
9. Linjuan Wu, Dongning Jin, Dan Wang, Xuping Jing, Peng Gong, Yali Qin, Mingzhou Chen. The two-stage interaction of Ebola virus VP40 with nucleoprotein results in a switch from viral RNA synthesis to virion assembly/budding. Protein Cell. 2022
10. Shanshan Fan, Zihang Xu, Pengfei Liu, Yali Qin, Mingzhou Chen. Enterovirus 71 2A Protease Inhibits P-Body Formation To Promote Viral RNA Synthesis. Journal of Virology. 2021
11. Linliang Zhang, Shixiong Zhou, Majuan Chen, Jie Yan, Yi Yang, Linjuan Wu, Dongning Jin, Lei Yin, Mingzhou Chen, Yali Qin. P300-mediated NEDD4 acetylation drives ebolavirus VP40 egress by enhancing NEDD4 ligase activity. PLoS Pathogens. 2021
12. Xianfeng Hui, Linliang Zhang, Lei Cao, Kun Huang, Ya Zhao, Yufei Zhang, Xi Chen, Xian Lin*, Mingzhou Chen*, Meilin Jin*. SARS-CoV-2 promote autophagy to suppress type I interferon response. Signal Transduction Targeted Therapy. 2021
13. Qi Cheng, Wenjing Huai, Xiaoyan Wu, Mingzhou Chen. Sumoylation of Human Parainfluenza Virus Type 3 Phosphoprotein Correlates with A Reduction in Viral Replication. Virologica Sinica. 2021
14. Yingcheng Zheng, Guoguo Zhu, Jun Yan, Yinglian Tang, Song Han, Jun Yin, Biwen Peng, Xiaohua He, Wanhong Liu, The late domain of prototype foamy virus Gag facilitates autophagic clearance of stress granules by promoting amphisome formation. Journal of Virology. 2020
15. Zhifei Li, Dong Guo, Yali Qin, Mingzhou Chen. PI4KB on Inclusion Bodies Formed by ER Membrane Remodeling Facilitates Replication of Human Parainfluenza Virus Type 3. Cell Reports. 2019
16. Shengwei Zhang, Yonggang Pei, Fengchao Lang, Kunfeng Sun, Rajnish Kumar Singh, Zachary L Lamplugh, Abhik Saha, Erle S Robertson*. EBNA3C facilitates RASSF1A downregulation through ubiquitin-mediated degradation and promoter hypermethylation to drive B-cell proliferation. PLoS Pathogens. 2019
17. Xiaodan Yang, Zhulong Hu, Qiang Zhang, Shanshan Fan, Yi Zhong, Dong Guo, Yali Qin, Mingzhou Chen. SG formation relies on eIF4GI-G3BP interaction which is targeted by picornavirus stress antagonists. Cell Discovery. 2019
18. Linliang Zhang, Yali Qin, Mingzhou Chen. Viral strategies for triggering and manipulating mitophagy. Autophagy. 2018
19. Zhulong Hu, Yuang Wang, Qiaopeng Tang, Xiaodan Yang, Yali Qin, Mingzhou Chen. Inclusion bodies of human parainfluenza virus type 3 inhibit antiviral stress granule formation by shielding viral RNAs. PLoS Pathogens. 2018
20. Xiaodan Yang, Zhulong Hu, Shanshan Fan, Qiang Zhang, Yi Zhong, Dong Guo, Yali Qin, Mingzhou Chen. Picornavirus 2A protease regulates stress granule formation to facilitate viral translation. PLoS Pathogens. 2018
21. Binbin Ding#, Linliang Zhang#, Zhifei Li, Yi Zhong, Qiaopeng Tang, Yali Qin, Mingzhou Chen. The Matrix Protein of Human Parainfluenza Virus Type 3 Induces Mitophagy that Suppresses Interferon Responses. Cell Host Microbe. 2017
22. Shengwei Zhang, Yanliang Jiang, Qi Cheng, Yi Zhong, Yali Qin, Mingzhou Chen. Inclusion Body Fusion of Human Parainfluenza Virus Type 3 Regulated by Acetylated α-Tubulin Enhances Viral Replication. Journal of Virology. 2017
23. Qin Yan, Linjuan Wu, Longyun Chen, Yali Qin, Zishu Pan, Mingzhou Chen. Vesicular stomatitis virus-based vaccines expressing EV71 virus-like particles elicit strong immune responses and protect newborn mice from lethal challenges. Vaccine. 2016
24. Guangyuan Zhang, Yi Zhong, Yali Qin, Mingzhou Chen. Interaction of Human Parainfluenza Virus Type 3 Nucleoprotein with Matrix Protein Mediates Internal Viral Protein Assembly. Journal of Virology. 2015
25. Guangyuan Zhang, Shengwei Zhang, Binbin Ding, Xiaodan Yang, Longyun Chen, Qin Yan, Yanliang Jiang, Yi Zhong, Mingzhou Chen. A leucine residue in the C terminus of human parainfluenza virus type 3 matrix protein is essential for efficient virus-like particle and virion release. Journal of Virology. 2014
26. Binbin Ding, Guangyuan Zhang, Xiaodan Yang, Shengwei Zhang, Longyun Chen, Qin Yan, Mengyao Xu, Amiya K Banerjee, Mingzhou Chen. Phosphoprotein of human parainfluenza virus type 3 blocks autophagosome-lysosome fusion to increase virus production. Cell Host Microbe. 2014
27. Shengwei Zhang, Longyun Chen, Guangyuan Zhang, Qin Yan, Xiaodan Yang, Binbin Ding, Qiaopeng Tang, Shengjun Sun, Zhulong Hu, Mingzhou Chen. An amino acid of human parainfluenza virus type 3 nucleoprotein is critical for template function and cytoplasmic inclusion body formation. Journal of Virology. 2013
28. Longyun Chen, Shengwei Zhang, Amiya K Banerjee, Mingzhou Chen. N-terminal phosphorylation of phosphoprotein of vesicular stomatitis virus is required for preventing nucleoprotein from binding to cellular RNAs and for functional template formation. Journal of Virology. 2013




