心肌梗死引起的缺血性心脏病是威胁全球人民生命健康的沉重负担,提高缺血心肌组织的血供和功能重建是解决该问题的科研攻关方向。而探索心梗后调控血管生成、改善心脏修复的潜在策略,对于缺血性心脏病的治疗具有重要意义。近期,Circulation Research发布了一项中国医学科学院阜外医院、犹他大学的重要研究,揭示内源性生物活性磷脂小分子——溶血磷脂酸(LPA)通过激活内皮细胞上的G蛋白偶联受体LPA2调控血管稳态和血管新生,在心脏缺血损伤修复和再生中发挥保护作用,为缺血性心脏病的临床治疗提供潜在靶点。
中国医学科学院阜外医院陈曦教授、郑哲教授,以及犹他大学朱伟铨教授领衔,阜外医院、心血管病疾病国家重点实验室博士后裴建秋和湖北大学蔡琳老师为共同第一作者。

该文章首先利用小鼠心梗模型证实心梗早期心脏LPA-LPA2信号激活,并在体外和体内验证激活的LPA2主要来自于血管内皮细胞基因表达上调;进一步采用全身和内皮细胞特异性Lpar2敲除小鼠进行心梗造模,证实LPA2缺失引起更严重的心脏功能下降、血管密度降低和心肌再生能力丢失;同时利用肢端缺血模型证实LPA2缺失引起下肢血流恢复受阻。在机制研究方面,作者分离小鼠原代胸腹主动脉血管内皮细胞,发现LPA-LPA2通过激活下游的Raf1-Erk和PI3K-Akt通路促进内皮细胞增殖,并通过PKD1-CD36-VEGFR2参与内皮的成管调节。最后,利用腺病毒Ad-Lpar2介导的过表达或特异性激动剂DBIBB进行药理性激活LPA2,可促进血管生成、降低血管渗漏从而维持心梗后的血管稳态,达到改善心脏功能和减轻有害重构的效果。
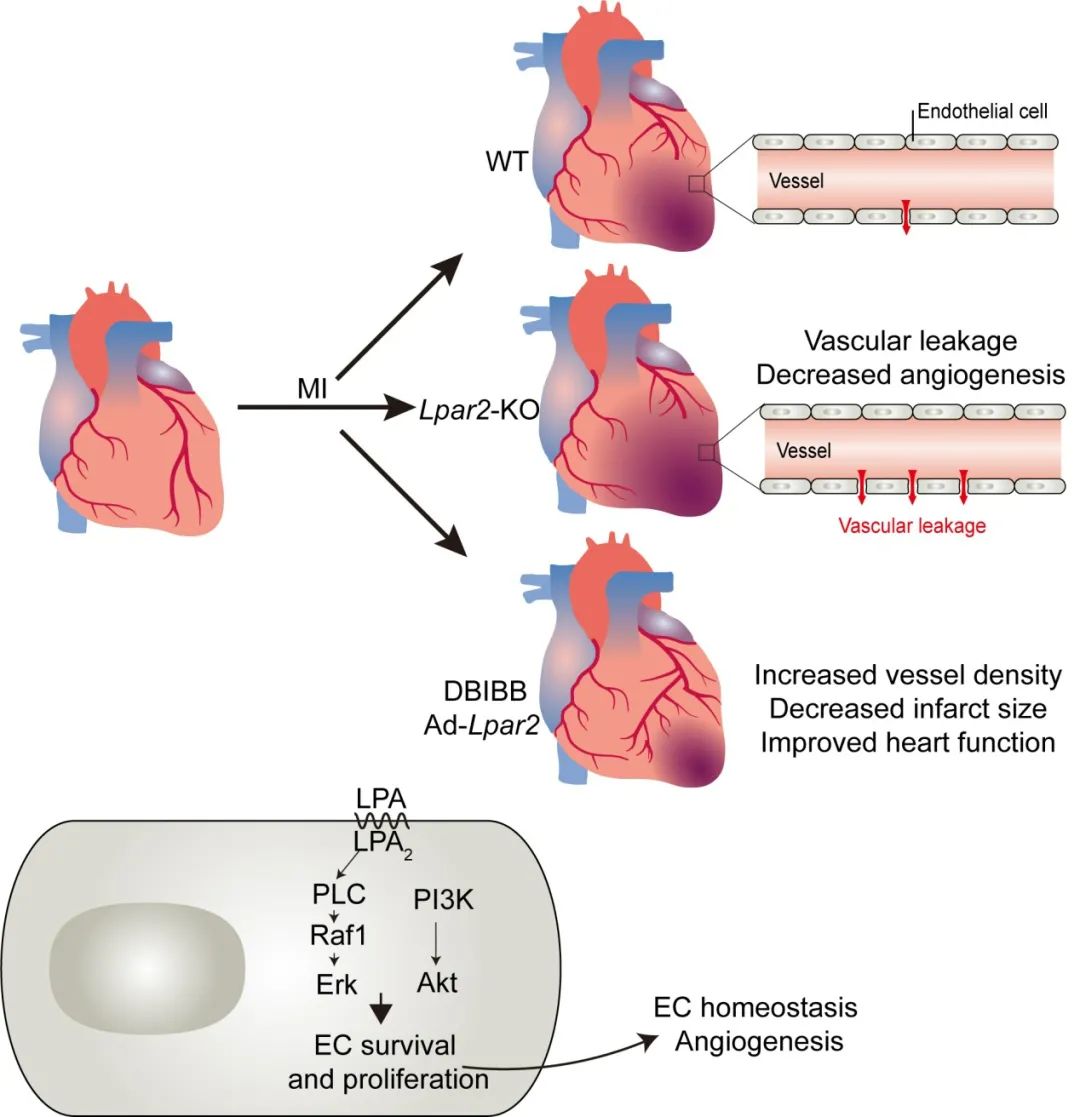
该研究发现并证实了LPA-LPA2信号在组织缺血损伤后血管稳态维持和血管新生过程中的重要作用,阐明了LPA-LPA2激活通过Raf1-Erk和PI3K-Akt通路促进内皮细胞增殖、在缺氧条件下发挥内皮保护作用,并通过PKD1-CD36-VEGFR2参与成管功能调节的信号机制。LPA2可作为心脏缺血损伤修复的潜在干预靶点,其特异性激动剂DBIBB可能具有重要的临床应用价值。
该工作得到了阜外医院丛祥凤教授、王芳副研究员、郭宏伟主任、孙晓刚主任,以及Sanford Burnham Prebys Medical Discovery Institute的Jerold Chun教授等人的指导和支持,并得到国家自然科学基金(面上项目、重点项目和青年基金)、省部共建生物催化与酶工程国家重点实验室开放课题等资助。
蔡琳博士于2017年在北京协和医学院阜外医院获得博士学位,导师为陈曦教授。2020年12月份加入湖北大学生命科学学院,研究方向为心肌损伤修复与再生和代谢性心脏病研究。主持国家自然科学基金项目1项,并参与国家级科研课题多项;已发表SCI论文10篇,参编教材1部,包括以第一作者或者共同第一作者在国际权威杂志Cell Metabolism、Circulation research、Front Physiol等发表论文。
原文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.122.321036




