李珊珊/余希岚团队发现调控蛋白质稳态的新机制
作者:生命科学学院发布时间:2023年10月07日 09:08
湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室李珊珊/余希岚团队在Science子刊(Science Advances)上以长文形式(Article)发表了题为“Cla4 phosphorylates histone methyltransferase Set1 to prevent its degradation by the APC/Cdh1 complex”的研究论文。该研究以组蛋白甲基转移酶Set1为对象,揭示了一种广谱的调控蛋白稳定性的新机制。湖北大学博士研究生龚玄云静和讲师王姗姗为本文共同第一作者,余希岚教授为本文主要通讯作者,湖北大学为第一单位(图1)。

图1 论文首页
组蛋白是染色质的主要蛋白质组分,能够发生一系列翻译后修饰,这种修饰叫做组蛋白修饰。这些组蛋白修饰通过调控基因表达影响DNA修复、细胞周期、应激反应,进而影响发育、分化和衰老等多种生物学过程。H3K4me3是最重要的一种组蛋白修饰,由Set1/MLL家族甲基转移酶催化。Set1在基因表达、端粒沉默、细胞寿命以及癌症发生过程中都发挥重要调控作用。因此,阐明Set1蛋白的表达及调控机制具有重要理论意义。
由于在高等生物,Set1同源物众多,组成复杂,且分子量大,导致相关研究受到极大限制。而在单细胞酿酒酵母中,Set1是催化H3K4me3的唯一甲基转移酶,且在物种间高度保守,因此酵母是研究Set1家族功能和机制的理想模型。在本项工作中,研究人员巧妙地利用酿酒酵母为研究模型,发现Set1蛋白表达受到细胞周期的调控:Set1蛋白水平在G1期最低,且由蛋白酶体途径调控,APC/CCdh1为介导Set1降解的E3泛素连接酶。敲除CDH1,Set1蛋白水平得到回复,而过表达CDH1则会使Set1蛋白水平下降。这些结果说明,APC/CCdh1在G1期介导Set1泛素化,导致其被蛋白酶体降解。另一方面,研究人员发现激酶Cla4催化Set1第228位丝氨酸(Set1-S228)的磷酸化,抑制了Set1与Cdh1相互作用,从而阻止Set1被降解。
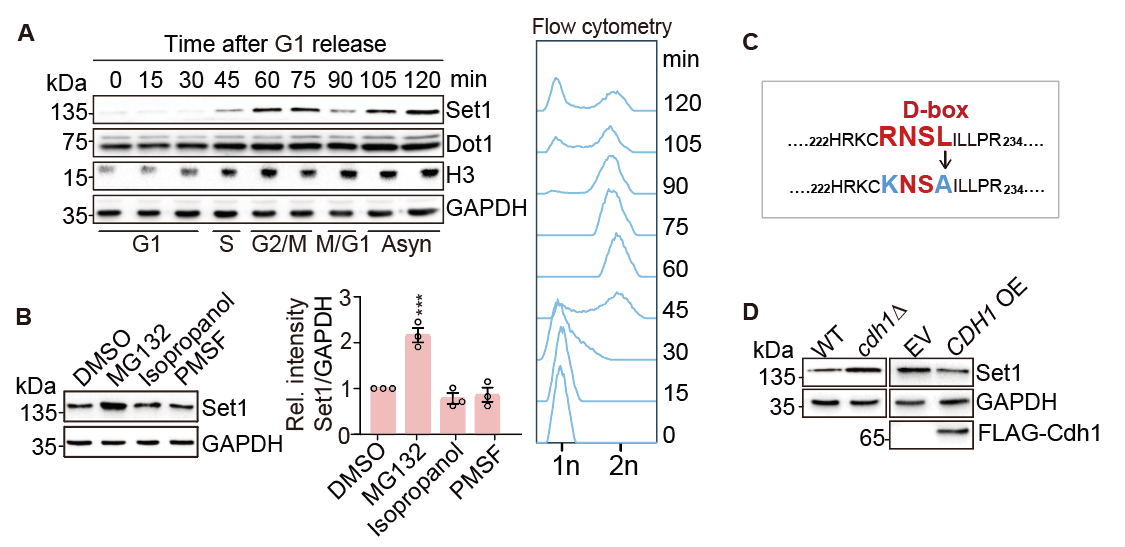
图2 Set1在G1期被APC/CCdh1降解。
此外,通过蛋白纯化与质谱技术,研究人员发现除了Set1,至少还有141个蛋白可被Cla4-APC/CCdh1共调控。这些蛋白含有既可以被Cla4识别也可以被Cdh1识别的一段序列,RXS/TL (RXS/TL)。余希岚教授将该序列命名为P-Box(protection box)。其中,S/T是潜在的Cla4磷酸化位点,当该位点发生磷酸化,Cdh1对P-Box的识别受到抑制,进而阻止靶蛋白发生泛素化,从而保护靶蛋白不受蛋白酶体系统降解。
余希岚教授一直从事糖代谢调控衰老与肿瘤发生的表观遗传学研究。自2015年底加盟湖北大学生命科学学院以来,近5年以湖北大学为第一单位在Nature Metabolism、Nature Structural & Molecular Biology、Science Advances (2篇)、Nature Communications (4篇)、Nucleic Acids Research (2篇)、Autophagy等国际知名期刊上发表20余篇高水平文章,并获得国家自然科学基金面上项目、青年项目、湖北省创新群体、湖北省杰青项目等多项国家级和省部级科研项目的支持。
原文链接:http://www.science.org/doi/10.1126/sciadv.adi7238



