近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室李珊珊/余希岚团队在Nature子刊(Nature Communications)上以长文形式(Article)发表了题为“PKA plays a conserved role in regulating gene expression and metabolic adaptation by phosphorylating Rpd3/HDAC1”的研究论文。该研究以酿酒酵母为模型,揭示了蛋白激酶A(PKA)在感知和响应外界营养变化中的新机制,并进一步在哺乳动物细胞和小鼠中验证了其保守性。湖北大学博士研究生代文静和博士后余奇为该论文共同第一作者,李珊珊教授和余希岚教授为该论文通讯作者,湖北大学为第一单位(图1)。

图1论文首页
李珊珊/余希岚教授课题组长期致力于研究代谢感知和应答过程中的表观遗传机制。早在2015年,李珊珊教授纯化并鉴定了糖代谢酶复合物SESAME,它可以直接磷酸化组蛋白,建立了细胞响应葡萄糖变化的表观遗传机制。在2022年,李珊珊/余希岚团队发现葡萄糖通过激活PKA蛋白激酶家族的催化亚基Tpk2来调控细胞自噬和衰老。在高浓度葡萄糖条件下,Tpk2磷酸化组蛋白去甲基化酶Jhd2并促进其降解,维持细胞的基础自噬水平和正常的时序性寿命;当细胞面临以蔗糖为碳源的代谢压力时,组蛋白乙酰转移酶复合体SAGA可乙酰化其亚基Ada3并形成同型二聚体,活性更高的SAGA二聚体可以正协同地催化组蛋白的乙酰化,进而高效地促进压力应激相关基因的表达,从而提高细胞抵抗环境压力的能力。但是,细胞如何将细胞外营养变化转导为SAGA结构和功能变化的分子机制仍不清楚。
在这项研究中,李珊珊/余希岚团队通过筛选、质谱以及生化技术发现SAGA被Rpd3L复合物去乙酰化,揭示了胞外蔗糖通过激活蛋白激酶A(PKA)从而调节Rpd3L和SAGA活性以促进细胞代谢转换的新机制。当以蔗糖为唯一碳源时,PKA的催化亚基Tpk2被激活,磷酸化Rpd3L的催化亚基Rpd3以抑制其去乙酰化Ada3的能力。此外,Tpk2磷酸化Rpd3L另一亚基Ash1,从而特异性降低Rpd3L和SAGA之间的相互作用。通过磷酸化Rpd3和Ash1,Tpk2抑制Rpd3L介导的Ada3去乙酰化,从而促进SAGA二聚化、核小体乙酰化以及参与蔗糖利用和三羧酸(TCA)循环的基因转录,导致代谢流从糖酵解转向TCA循环。更为重要的是,Tpk2对Rpd3的这种磷酸化依赖性抑制机制在肝细胞癌细胞中是保守的,人源的PKA可以磷酸化Rpd3的同源物HDAC1以增强TCA循环并促进细胞生长(图2)。该研究拓展了细胞感知和响应环境营养变化的见解,为理解肿瘤细胞快速适应微环境变化和肿瘤发生发展提供了理论支撑。
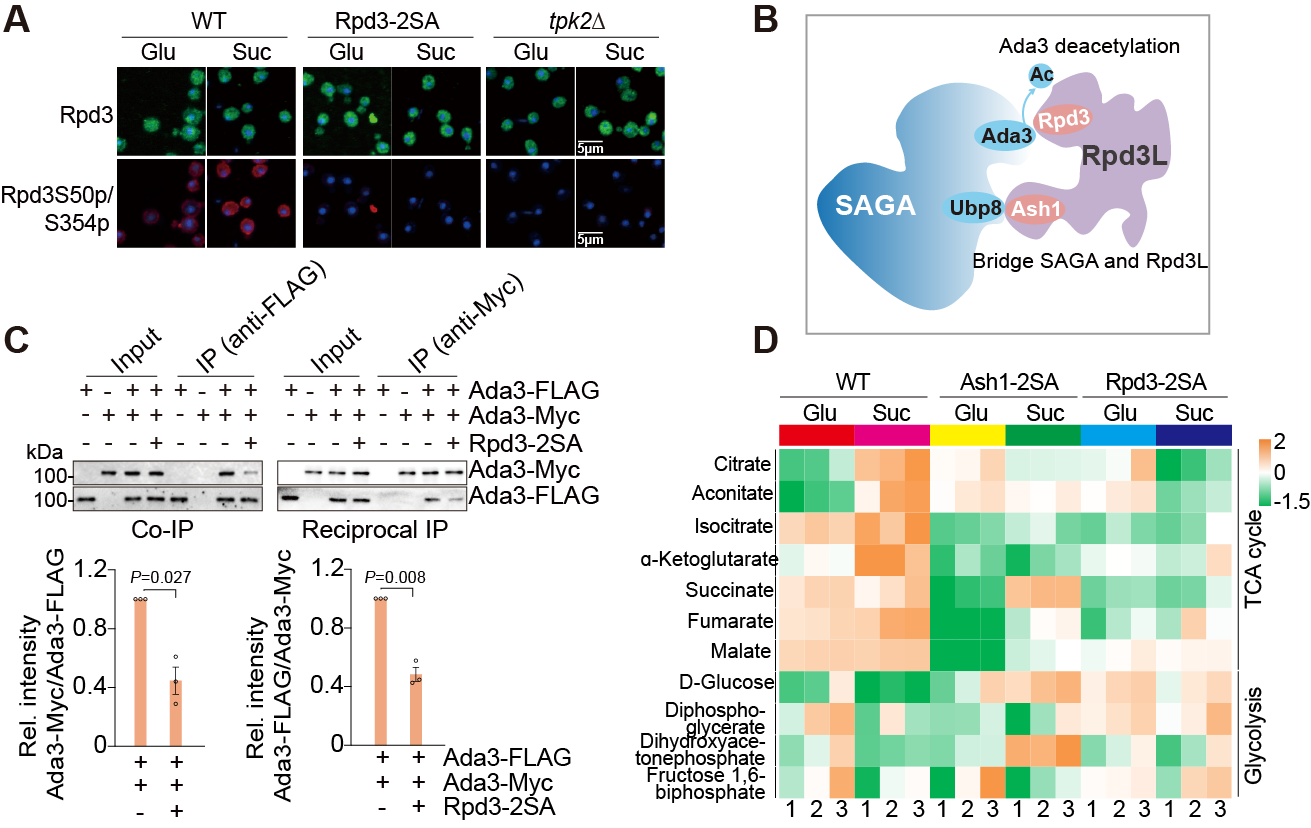
图2 Tpk2通过磷酸化Rpd3调控SAGA二聚化和代谢转换
据悉,李珊珊教授和余希岚教授团队一直从事糖代谢与表观遗传调控研究。自2015年底加盟湖北大学生命科学学院以来,以湖北大学为第一单位在Nature Metabolism、Nature Structural & Molecular Biology、Science Advances (2篇)、Nature Communications (5篇)、Nucleic Acids Research (2篇)、Cell Discovery、Oncogene等国际知名权威期刊上发表20余篇高水平文章,并获得国家自然科学基金、湖北省创新群体、湖北省杰青项目等多项国家级和省部级科研项目的支持。
原文链接:https://www.nature.com/articles/s41467-025-59064-y
审核:李爱涛
![]() 地址导航:湖北省武汉市武昌区友谊大道368号
地址导航:湖北省武汉市武昌区友谊大道368号![]() 邮政编码:430062
邮政编码:430062![]() 联系电话:(027)88664102
联系电话:(027)88664102
