近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室魏子贡教授团队以“De novo design of mini-binder proteins against IL-2 receptor β chain”为题在International Journal of Biological Macromolecules(中科院一区,IF=7.7)上发表论文,利用基于Rosetta的方法从头设计了针对IL-2受体β亚基(IL-2Rβ)的mini-binder。我院讲师明珂和硕士研究生邢班彬为本文共同第一作者,魏子贡教授为本文通讯作者。
免疫治疗是一种重要的癌症治疗手段。IL-2是激活T细胞、促进其细胞毒性的关键细胞因子,高剂量的IL-2已被批准用于多种肿瘤疾病的治疗。然而,高剂量的IL-2也存在一些副作用,例如引起严重的毛细血管渗漏综合征。同时,IL-2对机体也存在一些负面影响,包括移植物抗宿主反应、自身免疫疾病等。因此,在必要时应对其功能进行阻断。
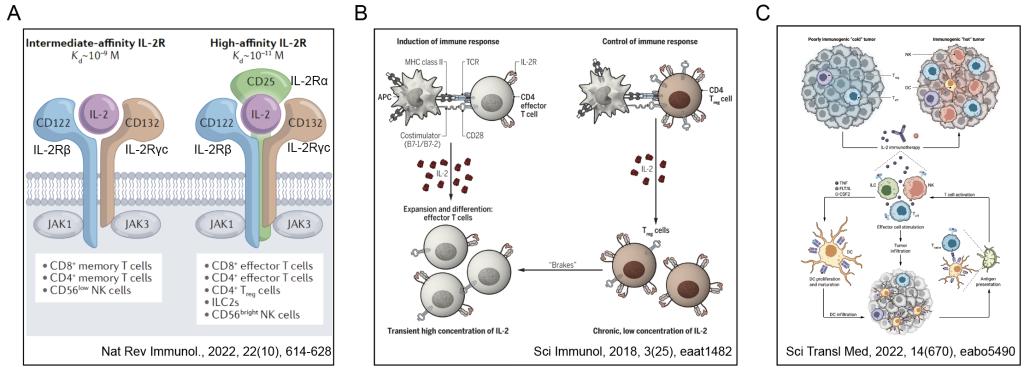
图1 IL-2的作用及机制
(A)IL-2与IL-2R的结合;(B)IL-2对T细胞的激活作用;(C)基于IL-2的抗肿瘤治疗
IL-2通过与IL-2受体(IL-2R)结合来发挥作用,低剂量IL-2优先与IL-2Rαbgc三聚体结合,激活调节性T细胞;当三聚体受体饱和时,IL-2则与IL-2Rbgc二聚体结合。IL-2Rgc亚基是多种细胞因子受体的共同组成成分,包括IL-2、IL-15、IL-4、IL-7、IL-21等,而IL-2Rb只存在于IL-2和IL-15受体。因此,选择性阻断IL-2与IL-2Rb的结合是降低IL-2副作用,同时避免阻断其他细胞因子作用的有效策略。
利用蛋白质从头设计,可以快速地实现针对任一靶点、任一位置设计具有全新结构的mini-binder,从而精准调控靶点蛋白的功能,对于疾病的治疗或干预具有重要意义。因此,课题组以IL-2Rb为靶点,利用基于Rosetta的方法,从头设计了数个全新的特异性的mini-binder。Mini-binder作为一种分子量小、结构简单的蛋白,其热稳定性高且易于表达。课题组随后通过细胞实验筛选出一个对IL-2信号阻断作用最强的mini-binder(binder1)。分子动力学模拟表明, binder1/IL-2Rβ复合物的自由能较IL-2/IL-2Rβ更低,表明binder1对IL-2Rβ的亲和力高于IL-2。自由能分解表明和分子对接显示IL-2Rβ的ARG35和ARG131可能是使mini-binder亲和力更高的两个关键氨基酸。这为后续binder的优化奠定了基础。
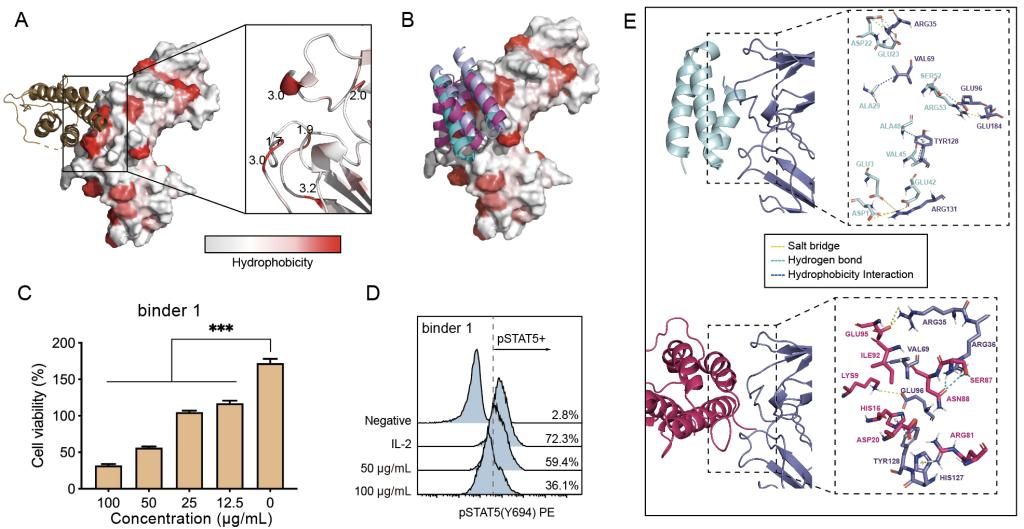
图2 mini-binder与IL-2Rb结合并阻断IL-2信号通路
(A)IL-2Rb疏水界面分析;(B)Mini-binder与IL-2Rb的结合模式;(C)Binder1对IL-2依赖的CTLL-2细胞生长的抑制作用;(D)Binder1对IL-2介导的STAT5磷酸化的抑制作用;(E)Binder1和IL-2与IL-2Rb的关键相互作用。
魏子贡教授团队长期从事病原毒力因子的结构解析与药物设计。团队围绕严重危害规模化健康养殖过程中的感染相关病原微生物,进行关键复制酶或结构蛋白的原子结构解析,并基于此进行大分子药物如疫苗、纳米抗体、mini-binder和小分子药物如中药单体、化学小分子药物的高通量筛选与计算设计,目前已取得系列创新性研究进展。
团队长期招收具有药学、生化与分子生物学、微生物学等学科背景的研究生,欢迎各位同学报考。
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.133834