马立新团队在多元化肿瘤治疗领域取得新进展
作者:生命科学学院发布时间:2022年10月30日 10:25
近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室马立新教授团队在多途径联合抗肿瘤领域取得新进展。相关成果“Combination of an autophagy inhibitor with immunoadjuvants and an anti-PD-L1 antibody in multifunctional nanoparticles for enhanced breast cancer immunotherapy”(共载自噬抑制剂和免疫佐剂以及免疫检查点抑制剂的多功能纳米粒用于治疗乳腺癌的研究)于近日发表于国际权威期刊BMC medicine(IF: 11.150)(图1)。湖北大学生命科学学院教师程祎斌为论文第一作者,马立新教授和罗静雯副教授为该论文通讯作者,湖北大学为第一单位。

图1. 文章首页
近年来,学者们致力于开发治疗术后残留肿瘤和预防肿瘤复发转移的新方法,包括联合使用化疗、免疫治疗、基因治疗、免疫检查点疗法和CAR-T技术其中的两种或者多种疗法。虽然联合治疗比单独治疗更有效,但由于肿瘤微环境中存在的T细胞较少(免疫“冷”环境),且存在大量的免疫抑制细胞,导致当前联合疗法尚不能满足临床需求。有研究表明肿瘤微环境中的自噬具有关键作用:通过调节免疫应答和免疫细胞的存活、凋亡、分化、激活、效应功能和转移,会促进肿瘤生长。因此,靶向并抑制自噬可能重塑肿瘤微环境,逆转免疫冷环境。此研究创造性地将靶向肿瘤的纳米给药系统与自噬抑制、免疫治疗、免疫检查点疗法和化疗联合起来,实现五位一体的多元化的抗肿瘤效果。
本研究基于聚乙烯亚胺衍生物开发一种PD-L1和CD44反应性的多功能纳米粒,并装载两种化疗药物(紫杉醇和氯喹)、抗原(卵白蛋白)、免疫增强剂(CpG)和免疫检查点抑制剂(抗PD-L1抗体)。聚乙烯亚胺衍生物大大提高了纳米平台的载药能力和包封效率,且显著提高了其细胞摄取率。实验证实,抗PD-L1抗体能强烈抑制小鼠乳腺癌,提高肿瘤部位CD4+和CD8+ T细胞水平。此外,氯喹逆转了免疫冷环境,提高了化疗和免疫检查点抑制剂的抗肿瘤效果,同时诱导了免疫记忆,观察期内阻止了小鼠乳腺癌的肺转移。该研究为合理设计纳米递药系统提供了一种很有前途的方法,它能同时用于主动靶向、自噬抑制和化疗,还能同时装载小分子药物和大分子药物,还可以与免疫检查点抑制剂结合用于增强乳腺癌治疗(图2)。
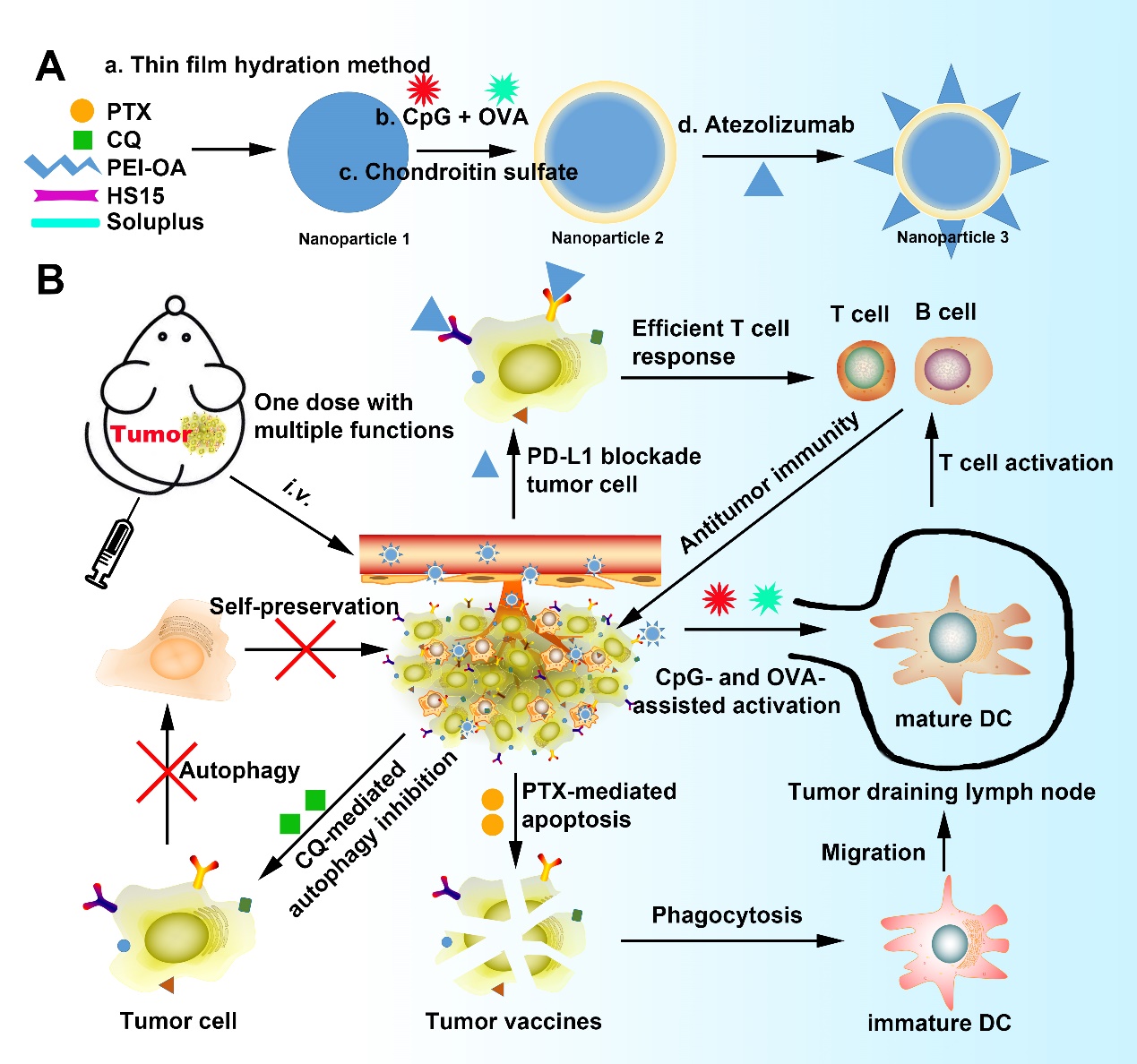
图2. 多功能纳米给药系统的构建及其用于体内肿瘤治疗的原理图
据悉,马立新教授团队一直从事可编程核酸酶的发掘及应用研究。近年来,马立新教授团队以湖北大学为通讯单位在Nucleic Acids Research、Nano Today、Advanced Science、Small、Biosensors and Bioelectronics、Chemical Communications、ACS Synthetic Biology等国际权威期刊上发表多篇高水平论文。
论文链接:https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-022-02614-8



